Tatanama Alkohol
a. IUPAC
1) Pemberian nama alkohol dilakukan dengan mengganti akhiran –a pada nama alkana dengan –ol.
2) Tentukan rantai utama (rantai dengan jumlah atom karbon paling panjang.
3) Tentukan substituen yang terikat rantai utama.
4) Penomoran substituen dimulai dari ujung yang terdapat gugus hidroksi (-OH) dengan nomor atom C paling rendah.
5) Jika terdapat 2/lebih substituen berbeda, dalam penulisan harus disusun berdasarkan urutan abjad huruf pertama nama substituen.
6) Awalan di-, tri-, sek-, ters-, tidak perlu diperhatikan dalam penentuan urutan abjad sedangkan awalan yang tidak dipisahkan dengan tanda hubung (antara lain : iso-, dan neo-) diperhatikan dalam penentuan urutan abjad.
b. Trivial (Nama Umum)
1) Tentukan gugus alkil yang mengikat gugus hidroksil.
2) Tambahkan akhiran “alkohol” setelah nama substituen.
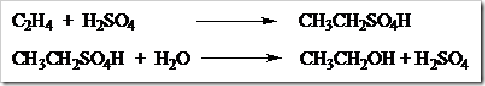
Tata Nama Eter, Aturan Penamaan, IUPAC, Trivial, Contoh, Senyawa Kimia - Eteratau alkoksi alkana terbentuk dari dua alkohol yang bereaksi dengan melepaskan molekul air.
Contoh :
C2H5OH
C2H5–OH
→
C2H5–O–C2H5
+
H2O
etanol
+
etanol
→
Etoksi etana
air
Secara umum, rumus molekul eter dapat dituliskan seperti berikut.
R–O–R'
Gugus fungsi –O– terikat pada dua gugus alkil. Gugus alkil dapat sama tetapi dapat juga berbeda. Perhatikan rumus molekul etoksi etana di atas. Jumlah atom C = 4, H = 10, dan O = 1. Jika dituliskan rumus molekulnya adalah C4H10O. Secara umum rumus molekul eter adalah seperti berikut.
CnH2n+2O
Tata Nama Eter
Tata nama eter dapat dilakukan dengan sistem IUPAC dan nama trivial. Menurut sistem IUPAC eter disebut juga alkoksi alkana. Tata nama menurut IUPAC dilakukan dengan menetapkan alkil yang lebih kecil sebagai alkoksi dan alkil yang lebih besar sebagai alkana. Tata nama dengan nama trivial dilakukan dengan menyebutkan nama alkil sesuai urutan abjad dan diakhiri eter. Jika kedua alkil sama digunakan awalan -di. Perhatikan tata nama senyawa eter berikut.
Tabel 1. Contoh Tata Nama pada Eter
No.
Rumus Struktur
Tata Nama IUPAC
Tata Nama Trivial
1.
metoksi isopropana
isopropil metil eter
2.
C2H5–O–C2H5
etoksi etana
dietil eter
b. Keisomeran Eter
Eter dengan rumus umum R–O–R' mempunyai keisomeran fungsi dengan alkohol (R–OH).
Contoh :
CH3CH2CH2–OH
1-propanol
CH3–CH2–O–CH3
metoksi etana
1-propanol dan metoksi etana memiliki rumus molekul yang sama yaitu C3H8O.
C2H5OH
C2H5–OH
→
C2H5–O–C2H5
+
H2O
etanol
+
etanol
→
Etoksi etana
air
Tata Nama Eter
No.
Rumus Struktur
Tata Nama IUPAC
Tata Nama Trivial
1.
metoksi isopropana
isopropil metil eter
2.
C2H5–O–C2H5
etoksi etana
dietil eter
Tata nama keton
Aturan Penamaan, IUPAC, Trivial, Contoh, Senyawa Kimia -Keton atau alkanon merupakan gugus fungsi yang mengandung gugus karbonil (C=O) yang diikat oleh dua gugus alkil.
Perhatikan contoh berikut!
Jadi rumus umum dari keton adalah seperti berikut.
Senyawa pada contoh di atas memiliki rumus molekul C3H6O.
Jadi keton mempunyai rumus molekul yang seperti berikut.
CnH2nO
Rumus molekul keton sama dengan rumus molekul aldehida. Oleh karena itu, keton dan aldehida merupakan isomer fungsional.
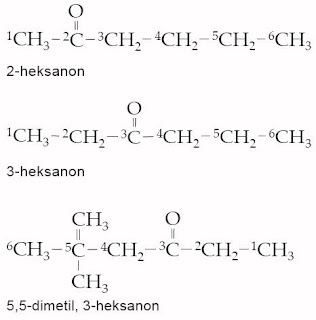
a. Tata Nama Keton
Tata nama untuk keton menurut sistem IUPAC yaitu dengan mengubah akhiran -a pada alkana dengan huruf -on. Tentukan rantai terpanjang yang melewati gugus fungsi –CO–. Penomoran dimulai dari ujung terdekat gugus fungsi.
Contoh :
Tata nama trivial keton, diambilkan dari nama alkil yang melekat pada gugus karbonil kemudian ditambahkan kata keton. Perhatikan tata nama IUPAC dan trivial dari keton pada tabel berikut.
Tabel 1. Nama IUPAC dan Trivial Keton
Rumus
Molekul
|
Struktur
|
Nama IUPAC
|
Nama Trivial
|
C3H6O
|
propanon
|
aseton (dimetil keton)
| |
C4H8O
|
2-butanon
|
etil metil keton
| |
C5H10O
|
3-pentanon
|
dietil keton
| |
C5H10O
|
3-metil-2-butanon
|
isopropil metil keton
|
b. Isomer Gugus Fungsi Keton
Keton dapat berisomeri kerangka, posisi atau fungsi.
1) Isomer kerangka terjadi karena perbedaan kerangka atom karbonnya.
Contoh :
2) Isomer posisi terjadi karena perbedaan letak gugus karbonil.
Contoh :
3) Isomer fungsi terjadi karena memiliki rumus molekul sama.
Contoh :
Rumus molekul 2-propanon dan propanal sama yaitu C3H6O.
Tatanama Asam karboksilat
a. IUPAC
- Pemberian nama asam karboksilat dilakukan dengan mengganti akhiran –a pada nama alkana dengan –oat.
Contoh :
- Tentukan rantai utama (rantai dengan jumlah atom karbon paling panjang yang mengandung gugus karboksil).
Contoh :
- Tentukan substituen yang terikat rantai utama.
Contoh :
- Penomoran substituen dimulai dari atom C gugus karboksil.
Contoh :
- Jika terdapat 2/lebih substituen berbeda dalam penulisan harus disusun berdasarkan urutan abjad huruf pertama nama substituen.
Contoh :
- Penambahan kata “asam” pada awal nama senyawa.
Contoh :
- Awalan di-, tri-, sek-, ters-, tidak perlu diperhatikan dalam penentuan urutan abjad sedangkan awalan yang tidak dipisahkan dengan tanda hubung (antara lain : iso-, dan neo-) diperhatikan dalam penentuan urutan abjad.
Contoh : bukan Asam-3-neopentil-2-metilheksanoat tetapi Asam 2-metil-3-neopentilheksanoat
b. Trivial (Nama Umum)
- Tak bercabang
Berikut ini daftar nama trivial beberapa asam karboksilat yang tidak bercabang :
- Bercabang
a) Tentukan rantai utama (rantai dengan jumlah atom karbon paling panjang yang terdapat gugus karboksil).
Contoh :
b) Tentukan substituen yang terikat pada rantai utama.
Contoh:
c) Penambahan kata “asam” pada awal nama senyawa.
d) Penomoran substituen dimulai dari atom karbon yang mengikat gugus karboksil dengan huruf α, β, γ.
Contoh :